2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
2023年2月17日,国家药品监督管理局发布《国家药监局 国家卫生健康委 国家医保局关于做好第三批实施医疗器械唯一
标识工作的公告(2023年第22号)》指出将确定部分临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗
美容相关产品等部分第二类医疗器械作为第三批医疗器械唯一标识实施品种。2024年6月1日起生产的医疗器械应当具有
医疗器械唯一标识;此前已生产的第三批实施唯一标识的产品可不具有唯一标识。生产日期以医疗器械标签为准。
第三批实施医疗器械唯一标识的产品目录包括103个品种,如超声手术设备附件、医用激光光纤、高频手术设备、电动吻
合器、血管缝合装置、腹膜透析设备、起搏系统分析设备、防护服、助听器、血细胞分析仪器等。









什么是 Basic UDI?
Basic UDI是设备模型的主要标识符。它是在设备使用单位级别分配的DI。它是UDI数据库中记录的主要关键字,并且
在相关证书和欧盟符合性声明中引用。
比如:1. CE证书、2.CE符合性声明、3.CE技术文件、4.SSCP、5.自由贸易证书等
Basic UDI也就是GS1全球型号代码(Global Model Number GMN),用于对欧洲医疗器械数据库(FUDAMED)中的医疗
器械进行分组。
GMN用于识别医疗器械的产品型号或产品系列,而不区分规格、颜色、版本、语种等非关键参数:不得使用GTIN/DI代替
GMN,一个GMN可对应多个GTIN/DI。








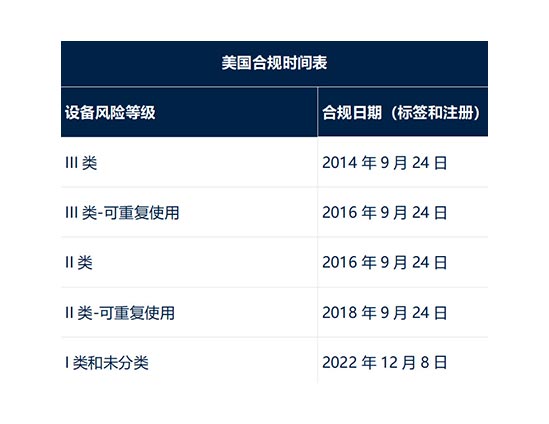
2022 年 7 月 22 日,FDA 发布了最终指南:唯一设备标识:关于 I 类和非分类设备的合规日期、直接标记和特定设备
的全球唯一设备标识数据库要求的政策。
本最终指南描述了 FDA 关于某些 I 类设备的 GUDID 提交要求的合规政策,这些设备被认为是消费者健康产品。此外,
FDA 不打算对 I 类和非分类设备强制执行 GUDID 提交要求,植入式除外,在 2022 年 12 月 8 日之前,生命支持或维
持生命的设备,无论它们是否是消费者健康产品。
I/LS/LS 设备,包括 II/LS/LS 类设备,已经预计符合 GUDID 提交要求。这一新日期将本指南 2020 年 7 月版中发布的
现有 FDA 合规政策延长了 75 天。